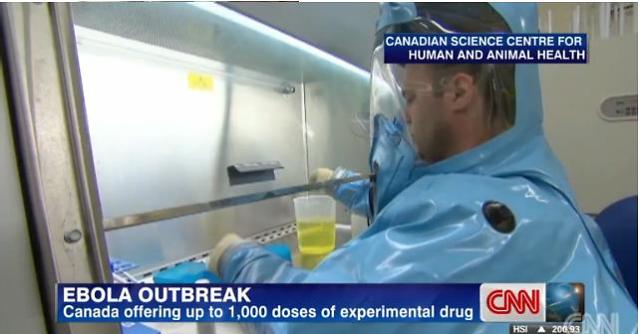
[사진 출처: CNN 동영상 캡쳐]
AP에 따르면 마리 폴 WHO 사무부총장은 9일(현지시간) “이번 주 WHO 전문가 회의에서 그동안 유효성과 안전성 등을 평가하기 위해 임상시험을 한 결과 글락소스미스클라인(GSK)과 뉴링크앤드머크가 각각 제조한 에볼라 바이러스 백신이 상당한 수준의 안전성을 갖췄다는 데 의견을 모았다”며 “이 두가지 실험용 에볼라 바이러스 백신에 대해 서아프리카에서 이른바 '임상 3상' 테스트를 하기로 했다”고 말했다.
지난해 12월 뉴링크앤드머크의 실험용 에볼라 바이러스 백신이 일부 참여자들이 일시적인 관절 통증 등의 증세를 나타내 일시적으로 투여가 중단됐던 것에 대해 폴 부총장은 “투약을 중단할 정도로 심각한 부작용이 아니었고 일시적이고 상당히 약한 수준이었다”며 “다른 실험용 에볼라 바이러스 백신에서는 그런 부작용이 아직 보고된 바 없다”고 밝혔다.
WHO 전문가회의를 주재했던 헬렌 리스 교수는 "그 동안의 실험을 통해 안전성을 확인하는데 매우 고무적인 진전이 있었다“며 ”에볼라 바이러스 발병 지역에서 이른 시일 내에 추가 임상시험을 하는 것이 필요하다“고 말했다.
©'5개국어 글로벌 경제신문' 아주경제. 무단전재·재배포 금지


![[르포] 중력 6배에 짓눌려 기절 직전…전투기 조종사 비행환경 적응훈련(영상)](https://image.ajunews.com/content/image/2024/02/29/20240229181518601151_258_161.jpg)



