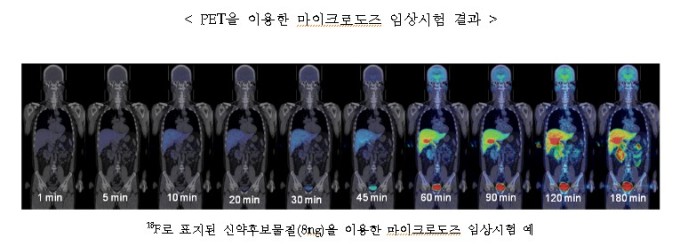
식품의약품안전청은 첨단 임상시험 기술인 ‘마이크로도즈 임상시험 가이드라인’이 이르면 8월에 마련된다고 26일 밝혔다.
마이크로도즈 임상시험은 피험자에게 건강상 무해한 극소량(100㎍)의 신약개발 후보물질을 소수(10명 이하)의 건강한 사람에게 투여해 동태를 관찰하는 방법이다.
극소량을 투여하기 때문에 인체에는 무해하고 인체반응을 관찰해 신약개발의 성공 가능성을 파악할 수 있다는 장점이 있다.
일반적으로 신약개발은 장기간(10년), 많은 비용(평균 1조원)이 소요되며 이 비용 가운데 60%가 임상시험에 투자되지만 성공률은 8%에 불과한 실정이다.
식약청은 마이크로도즈 임상시험 기술을 활용하면 신약 임상시험 기간은 절반으로 소요비용은 1/5로 줄일 수 있으며 성공률도 30%까지 높일 수 있을 것으로 전망하고 있다.
가이드라인의 주요 내용은 △목적 및 적용범위 △시험물질의 분석법 △비임상시험 요건자료 △투여량 설정방법 △품질관리 등으로 구성된다.
현재 최종안에 대한 전문가 의견을 수렴 중이며 이르면 8월경 최종 확정할 예정이다.
식약청은 “이번 ‘마이크로도즈 임상시험’ 가이드라인이 마련되면 임상시험 강국으로서 입지를 강화시킬 수 있을 것”이라고 설명했다.
마이크로도즈 임상시험 가이드라인이 마련돼 있는 국가는 미국과 EU, 일본 등에 불과하며 영상진단용 방사성 의약품 개발에 활용되고 있다.
현재 미국은 192건, EU는 69건의 마이크로도즈 임상시험이 허가됐다.
©'5개국어 글로벌 경제신문' 아주경제. 무단전재·재배포 금지


![[르포] 중력 6배에 짓눌려 기절 직전…전투기 조종사 비행환경 적응훈련(영상)](https://image.ajunews.com/content/image/2024/02/29/20240229181518601151_258_161.jpg)



