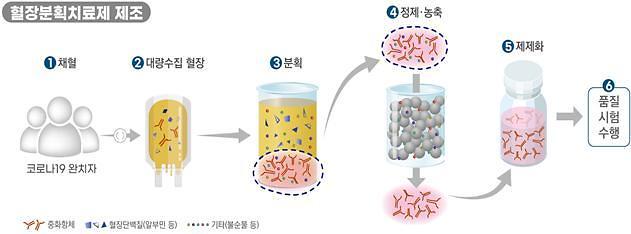
혈장분획치료제 제조방법 [자료=식품의약품안전처 제공]
GC5131은 코로나19 완치자의 혈장을 이용해 개발 중인 ‘고면역글로불린(Hyper-immune Globulin)’ 성분 의약품이다. 혈장분획치료제는 코로나19 완치자의 혈액 중 혈장을 대량으로 수집한 후 여러 공정을 거쳐 제품화하는 것으로, 코로나19 중화항체(바이러스 무력화 항체)가 농축된 면역글로불린(혈장 성분 중 면역에 중요한 역할을 하는 단백질)을 이용한다.
식약처는 지난 3월부터 혈장분획치료제 개발을 위해 사전상담을 진행해 왔다. 그 결과, 원료물질인 혈장이 인체에서 유래하고 중화항체를 이용해 질병을 치료하는 동일 원리를 적용한 제품이 예전부터 개발됨에 따라 임상1상을 면제하고 2상 허가를 승인했다.
현재 프랑스와 중국, 일본 및 이탈리아에서도 혈장분획치료제를 개발 중이며, 현재 6개의 소규모 임상시험이 진행 중에 있다.
©'5개국어 글로벌 경제신문' 아주경제. 무단전재·재배포 금지



![[르포] 중력 6배에 짓눌려 기절 직전…전투기 조종사 비행환경 적응훈련(영상)](https://image.ajunews.com/content/image/2024/02/29/20240229181518601151_258_161.jpg)



