
국내 연구진이 지방세포 분화 과정에서 유전자 번역과 세포 대사가 서로 밀접하게 상호작용한다는 새로운 사실을 밝혀냈다. 이번 연구는 비만과 당뇨 같은 대사질환 치료를 위한 새로운 전략 수립에 중요한 돌파구를 제공할 것으로 기대된다.
광주과학기술원(GIST) 의생명공학과 조준 교수와 순천향대학교 순천향의생명연구원 이미혜 교수 공동연구팀은 전사체, 번역체, 단백체를 통합한 다중체 분석을 통해 지방세포 분화 과정에서 유전자 번역과 대사 간 상호조절 메커니즘을 세계 최초로 규명했다고 24일 밝혔다.
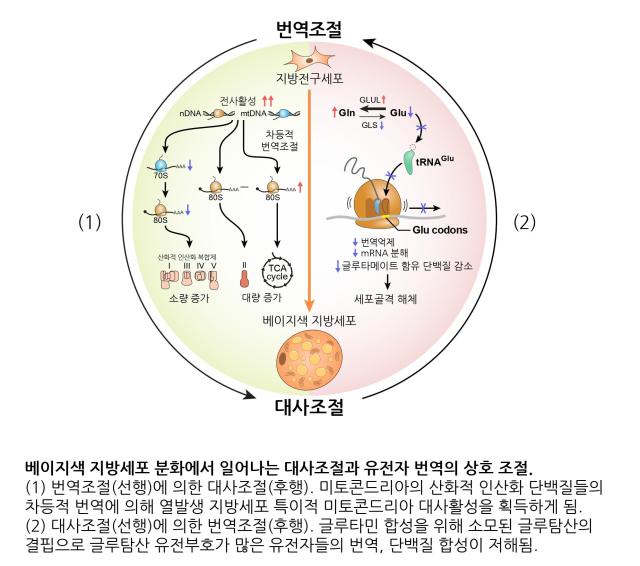
지방세포는 에너지를 저장하는 백색지방세포와 에너지를 소비해 열을 생성하는 갈색 및 베이지 지방세포로 나뉜다. 특히 베이지 지방세포는 백색지방세포에서 유래하며, 운동이나 추위 자극을 받으면 갈색지방세포와 유사한 특성을 띠어 대사질환 치료의 유망한 표적으로 주목받는다. 하지만 기존 연구는 주로 유전자가 RNA로 복사되는 전사 단계에 초점을 맞췄고, 단백질 생성 과정인 번역 단계나 단백질 자체에 대한 분석은 부족했다.
또 연구팀은 지방세포 분화 중 글루탐산 감소가 단백질 번역에 영향을 미친다는 사실을 발견했다. 글루탐산을 소모해 글루타민을 생성하는 유전자의 발현이 증가하면서 글루탐산 농도가 낮아지고, 이로 인해 글루탐산 유전부호를 가진 mRNA에서 리보솜이 정체되어 단백질 생성이 억제된다. 이 현상은 세포골격 구성 단백질의 생성을 줄여 지방세포 분화를 촉진한다.
조준 교수는 “대사 물질이 유전자 번역 조절에 직접 관여한다는 가능성을 분자 수준에서 입증한 첫 사례”라며 “대사와 유전자 번역이 독립적이지 않고 상호작용한다는 점을 보여줬다”고 밝혔다.
이번 연구는 한국연구재단, GIST-전남대병원 공동연구 등 다수 기관의 지원을 받아 수행됐으며, 연구결과는 국제학술지 ‘네이처 커뮤니케이션즈’에 지난 9일 게재됐다.
©'5개국어 글로벌 경제신문' 아주경제. 무단전재·재배포 금지



![[르포] 중력 6배에 짓눌려 기절 직전…전투기 조종사 비행환경 적응훈련(영상)](https://image.ajunews.com/content/image/2024/02/29/20240229181518601151_258_161.jpg)



